
Saturs
Citas sadaļasŪdeņradis ir vieglākais elements, un tam ir daudz rūpnieciskas izmantošanas, tostarp hidrogenētu tauku radīšana virtuvē un ogļūdeņražu ražošana no oglēm. Tā ir būtiska ūdens molekulu sastāvdaļa, un to var atdalīt, izmantojot nelielu daudzumu elektrības. Jūs varat arī ražot ūdeņraža gāzi, izmantojot dažus aktīvos metālus un stiprās skābes. Abas metodes ir salīdzinoši vienkāršas un ļaus jums savākt gāzes ūdeņradi.
Soļi
1. Metode no 2: ūdens nomaiņas izmantošana ar aktīvajiem metāliem
Savāc nepieciešamos materiālus. Lai savāktu ūdeņradi, izmantojot stipras skābes sajaukšanu ar aktīvo metālu, jums būs nepieciešama: Erlenmeijera kolba, gumijas aizbāznis, plastmasas caurules, destilēts ūdens, mēģenes, liels trauks, 3 molārā sālsskābe (HCl) un magnija vai cinka granulas.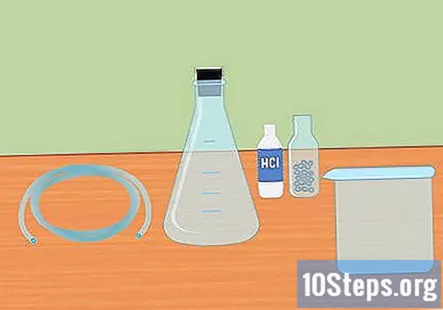
- Erlenmeijera kolba ir stikla kolba ar konisku dibenu un cilindrisku kaklu.
- Gumijas aizbāznis ir paredzēts kolbas augšdaļai, un caurules vidū tam jābūt ar caurumu.
- Šim eksperimentam derēs vai nu magnijs, vai cinks, jums abi nav vajadzīgi.
- Dažas no šīm izejvielām var būt jāpērk tiešsaistē vai laboratorijas preču veikalā.

Valkājiet atbilstošu aizsargaprīkojumu. Strādājot ar stipru skābi, piemēram, sālsskābi, jūs vēlaties pārliecināties, vai veicat atbilstošus drošības pasākumus. Laboratorijas mēteļa, cimdu, slēgtu kurpju un acu aizsardzības līdzekļu lietošana ir būtiska.- Brillēm jābūt aptītām ap jūsu acu malām, lai pasargātu tās no šļakatām.
- Valkājiet cimdus, kas ir piemēroti pareizi, lai jūs saglabātu labu roku un pirkstu veiklību.
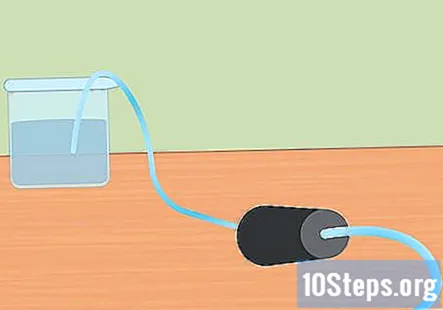
Sagatavojiet eksperimentālo iestatījumu. Ievietojiet caurules vienu galu gumijas aizbāžņa atverē. Jūs vēlaties, lai caurule ietu cauri gumijas aizbāznim un no gala nedaudz izlecētu. Piepildiet lielo trauku ar ūdeni un ievietojiet caurules brīvo galu ūdenī. Kad sāksies eksperiments, jūs ievietosiet gumijas aizbāzni Erlenmeijera kolbā.- Atlieciet šos gabalus malā, līdz esat gatavs tos izmantot.
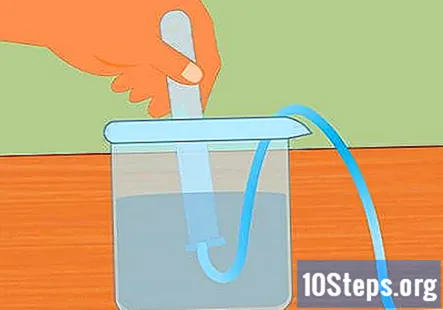
Iemērciet mēģeni ūdenī. Paņemiet vismaz vienu mēģeni (jūs varat izmantot vairāk, ja vēlaties savākt vairāk ūdeņraža) un iegremdējiet to ūdenī. Nolieciet cauruli tā, lai visi gaisa burbuļi varētu izkļūt. Novietojiet cauruli iegremdētās caurules augšpusē, kas piestiprināta pret gumijas aizbāzni pretējā galā.- Pirms sākat, ir svarīgi, lai visi gaisa burbuļi tiktu noņemti no mēģenes. Ja tā nav, caurulē savāktā gāze būs ne tikai ūdeņradis.
Erlenmeijera kolbā pievieno sālsskābi. Pievieno tik daudz sālsskābes, lai kolba būtu piepildīta apmēram pusceļā. Pietiek ar apmēram 100 ml. Pirms skābes pievienošanas pārliecinieties, ka kolba ir tīra un sausa. Valkājiet gumijas cimdus un piesardzīgi uzpildiet kolbu.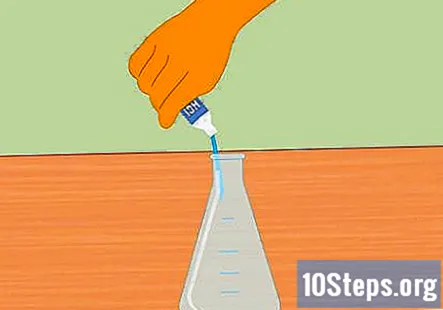
- Uzmanieties, lai skābē netiktu izšļakstīts ūdens. Skābei pievienotais ūdens var izraisīt eksploziju un ievainojumus.
Sāciet ķīmisko reakciju, pievienojot HCl metāla granulas. Kolbā esošajai sālsskābei pievieno nedaudz cinka vai magnija granulu. Precīza summa, kuru esat ievietojis, nav svarīga, taču reakcijas sākšanai vajadzētu pietikt ar nelielu sauju.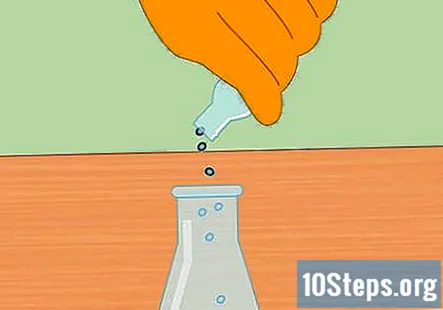
- Pēc granulu pievienošanas aizbāzni ievieto kolbā tā, lai sistēma tagad būtu aizvērta.
Savāc ūdeņradi iegremdētā mēģenē. Metālam reaģējot ar skābi, rodas gāzes ūdeņradis. Šis ūdeņradis nonāk kolbas augšdaļā, caur cauruli un ūdenī iegremdētā mēģenē. Gāze izspiedīs ūdeni, un mēģenes augšpusē vajadzētu redzēt burbuļa formu.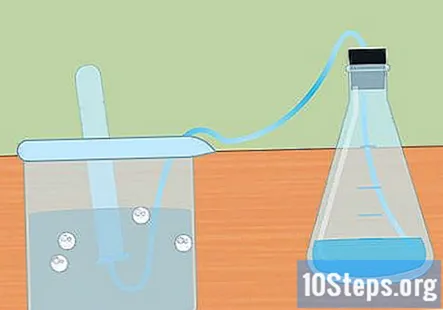
- Kad mēģene piepildās ar ūdeņradi, iegremdējiet citu mēģeni ar ūdeni un novietojiet to virs caurules. Jūs varat savākt tik daudz ūdeņraža, cik ražo jūsu reakcija.
- Turiet mēģenes uz leju, lai novērstu ūdeņraža gāzes izplūšanu gaisā.
Pārliecinieties, vai gāze ir ūdeņradis. Lai apstiprinātu, ka gāze ir ūdeņradis, varat veikt tā saukto šinas testu. Iededziniet sērkociņu un turiet to zem caurules. Jūs dzirdēsiet “pop” vai čīkstošu skaņu, kas norāda, ka ūdeņradis ir klāt.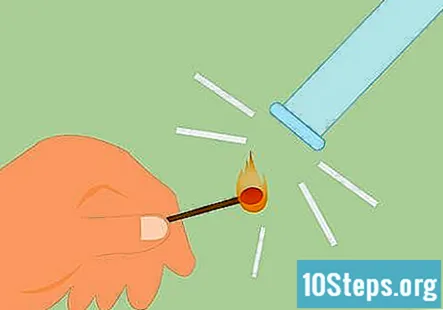
2. metode no 2: Elektrolīzes izmantošana
Savāc nepieciešamos materiālus. Šajā eksperimentā jūs izmantosiet elektrību, lai atdalītu ūdeņraža un skābekļa gāzes no ūdens molekulām. Lai savāktu ūdeņraža gāzi, izmantojot elektrolīzi, jums būs nepieciešama 9 voltu baterija, zīmulis, divas mēģenes, plastmasas trauks, ūdens, cepamā soda, divas lielas gumijas lentes (pēc izvēles) un akumulatora skava ar skavām galā.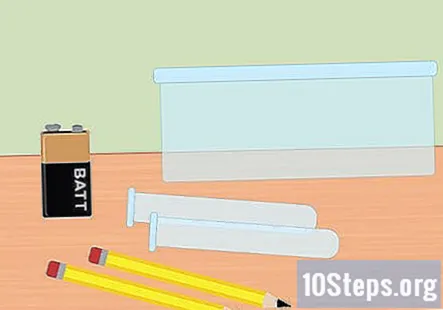
- Lai tas darbotos, zīmulī jābūt grafītam. Zīmulis 2 ir ideāls. Šim nolūkam derēs arī divi mazi grafīta gabali.
- Pietiek ar nelielu pārtikas uzglabāšanas trauku vai trauku.
- Pārliecinieties, vai akumulatora klipā var ievietot 9 voltu akumulatoru un vai tā galā ir sarkans un melns vads ar aligatora skavām. Šie skavas tiks izmantoti, lai pievienotu jūsu sistēmu akumulatoram.
Izņemiet dzēšgumiju no zīmuļa un salauziet zīmuli uz pusēm. Jums ir nepieciešami divi grafīta gabali, viens akumulatora pozitīvajam galam un negatīvajam akumulatora galam. Asināt katra zīmuļa gabala abus galus līdz punktam. Pārliecinieties, ka grafīts ir labi pakļauts.
- Šo soli var izlaist, ja jums jau ir divi tīra grafīta gabali.
Aptiniet 2 gumijas lentes ap konteineru X formā. Šis solis nav obligāts, taču tas ir vienkāršs veids, kā saglabāt mēģenes savā vietā eksperimenta laikā. Izstiepiet vienu gumijas joslu virs trauka un izstiepiet otru gumijas joslu tā, lai tā šķērsotu pirmo, veidojot X.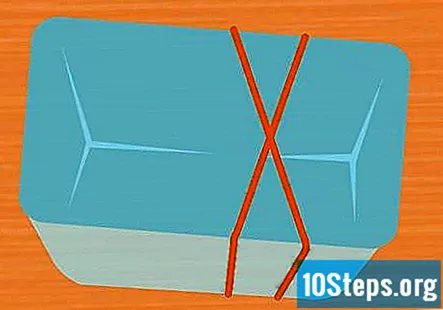
- Ja nelietojat gumijas lentes, pārliecinieties, ka mēģenes ir nostiprinātas ar lenti vai auklu tā, lai eksperimenta laikā tās paliktu otrādi.
Pagatavojiet cepamais sodas un ūdens šķīdumu. Cepamās soda izšķīdināšana ūdenī palīdzēs elektrību novadīt sistēmā. Precīzs pievienotās cepamās sodas daudzums nav svarīgs, taču pietiek ar apmēram 1 tējkaroti uz 1 glāzi ūdens. Maisiet, līdz tas pilnībā izšķīst.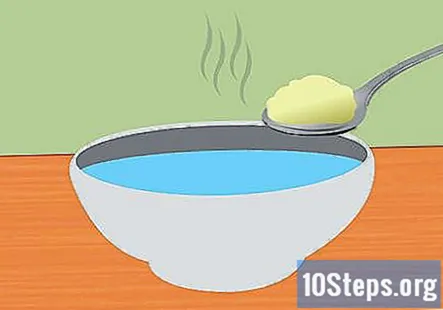
- Izmantojiet siltu ūdeni, lai paātrinātu sodas šķīdināšanu.
Piepildiet plastmasas trauku un mēģenes ar cepamā soda šķīdumu. Tvertnei jābūt pietiekami lielai, lai turētu abas mēģenes. Pievienojiet tik daudz šķīduma, lai tvertne būtu piepildīta apmēram trīs ceturtdaļas. Testa mēģenes iegremdē trauka šķīdumā un apgāž otrādi. Katru mēģeni ievieto gumijas joslas X krustā, lai to noturētu.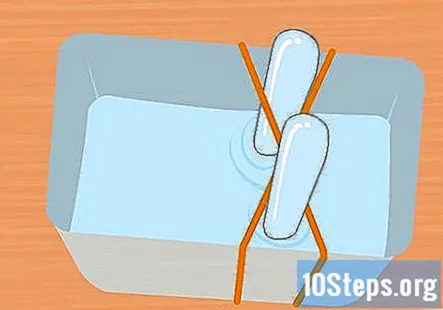
- Ir ļoti svarīgi, lai abas mēģenes būtu pilnīgi pilnas ar ūdeni un nepaliktu gaisa burbuļi.
Pievienojiet aligatora skavas grafītam. No akumulatora skavas paņemiet vienu skavu un piestipriniet to viena zīmuļa galā. Pārliecinieties, ka tas pieskaras pēc iespējas lielākajai daļai grafīta. Dariet to pašu ar atlikušo aligatora skavu un zīmuļa gabalu.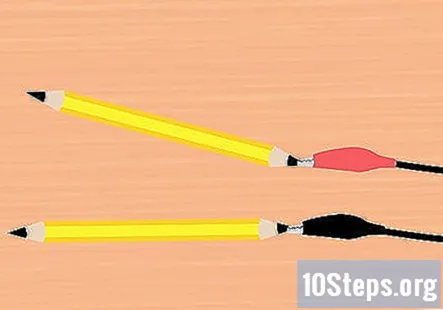
- Viens zīmulis jāpiestiprina pie sarkanās skavas un viens zīmulis pie melnās skavas.
Iebīdiet zīmuļa nenosprādzēto galu mēģenē. Turot testa mēģeni pilnībā iegremdētu, nedaudz nolieciet to, lai jūs varētu iebīdīt zīmuļa nenostiprināto galu mēģenē. Atkārtojiet šo procesu ar otru zīmuli un otru mēģeni.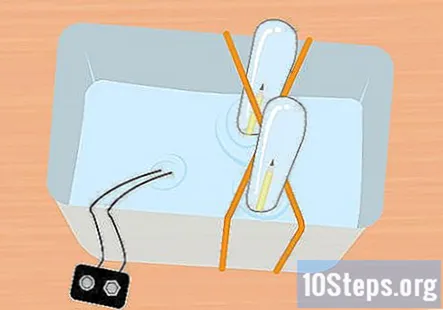
- Šajā brīdī visam jābūt zem ūdens, un katras mēģenes iekšpusē jābūt vienam zīmuļa gabalam.
- Akumulatora stiprinājuma galu, kas piestiprināts pie akumulatora, turiet ārpus ūdens.
Pievienojiet akumulatora skavu 9 voltu akumulatoram. Kad viss ir iestatīts, jūs tagad esat gatavs izmantot elektrību, ko nodrošina 9 voltu akumulators. Baterijas klipša galam vajadzētu būt izlecošam no konteinera, tāpēc vienkārši nofiksējiet akumulatoru vietā. Kad akumulators ir pievienots, jums vajadzētu pamanīt burbuļus, kas paceļas no grafīta gala un peld uz katras mēģenes augšdaļu.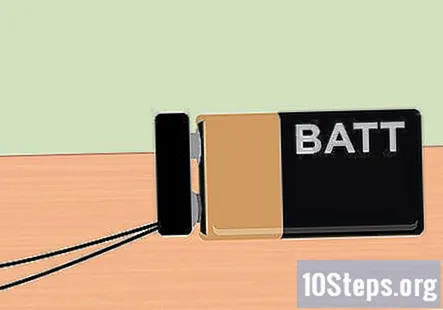
- Ja neredzat saražotus burbuļus, pārbaudiet, vai aligatora skavas ir cieši piestiprinātas pie zīmuļa grafīta. Pārbaudiet arī to, vai akumulators ir pilnībā uzlādēts.
- Testa caurule ar negatīvo vadu, kas piestiprināta pie zīmuļa, ražos ūdeņradi, savukārt testa caurule, kas piestiprināta pie akumulatora pozitīvās stieples, ražos skābekli.
Savāc ūdeņradi un skābekli abās mēģenēs, līdz katrā mēģenē ir daži centimetri gāzes. Atcerieties, ka caurulē, kas savienota ar akumulatora negatīvo galu, būs ūdeņradis, un skābeklis būs caurulē, kas savienots ar pozitīvo galu. Izņemiet mēģenes no burkas pa vienam. Turiet tos otrādi un ļaujiet ūdenim iztecēt. Gāze caurulēs paliks, kaut arī jūs to nevarat redzēt.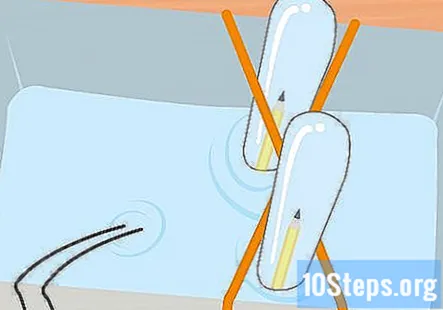
Pārbauda ūdeņraža klātbūtni. Jūs varat pārbaudīt ūdeņraža klātbūtni, sitot sērkociņu un turot liesmu līdz gāzei. Tas radīs ļoti izteiktu “čīkstoša popa” skaņu, ja tas ir ūdeņradis. Sērkociņa vietā var izmantot arī aizdedzinātu sveci.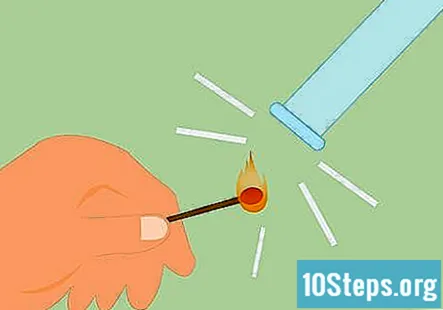
- Lai pārbaudītu skābekļa daudzumu mēģenē, kas bija savienota ar strāvas avota pozitīvo pusi, izpūtiet aizdedzinātu sērkociņu (vai sveci) un zem testa mēģenes ievietojiet vēl kvēlojošo galu. Ja svece atjaunojas, tajā ir skābeklis.
Kopienas jautājumi un atbildes
Vai man ir vajadzīgas divas mēģenes, ja es vēlos savākt tikai ūdeņradi?

Vides zinātnieks Bess Ruffs ir ģeogrāfijas doktorants Floridas štata universitātē. 2016. gadā viņa ieguvusi maģistra grādu vides zinātnē un vadībā Kalifornijas Universitātē Santa Barbarā. Viņa ir veikusi apsekojumus jūras telpiskās plānošanas projektiem Karību jūras reģionā un sniegusi pētniecības atbalstu kā ilgtspējīga līdzstrādniece Ilgtspējīgas zivsaimniecības grupā.

Cik daudz ūdeņraža var savākt no šī vienkāršā elektrolīzes eksperimenta? Un kāds būtu ūdeņraža gāzes spiediens?
Tas atkarigs. Reakcijas (ūdens sadalīšanās) ātrums ir balstīts uz akumulatora ampēriem un laiku, kas atlicis reaģēt. Parasti ūdeņradis atrodas aptuveni jūras līmeņa spiedienā, ja vien neveicat eksperimentu patiešām karstā vai aukstā vidē.
Kāpēc ūdeņradis savācas negatīvajā mēģenē
Sakarā ar to, kā ūdens molekulas dalās ar elektroniem, ūdeņraža atomi ir pozitīvi uzlādēti un skābekļa atomi ir negatīvi lādēti. Izplūstot gāzēm, pozitīvi lādēto ūdeņradi piesaistīs negatīvā caurule, savukārt negatīvi lādēto skābekli - pozitīvā.
Kāpēc gāze neizplūda no manas gāzes savākšanas caurules?
Tas ir ūdeņradis, gāze, kas ir vieglāka par visām pārējām, ieskaitot hēliju, kas nozīmē, ka tā paliks mēģenē tik ilgi, kamēr noslēgtais mēģenes gals būs augšpusē, jo pārējās gāzes to izspiež. Iemesls, kāpēc ūdeņraža vietā izmantojam hēliju, ir tas, ka tas nav viegli uzliesmojošs. Tas ir saistīts ar faktu, ka tā ir cēlmetāla gāze (tai ir pilna valences apvalks ar 8 elektroniem) un tāpēc tā nav reaktīva.
Vai gāze būtu ļoti viegli uzliesmojoša?
Jā. Skatiet Hindenburgas katastrofu vietnē YouTube. Cepelīni izmantoja ūdeņradi, jo tas bija vieglākais gāze, un tos bija diezgan viegli iegūt. Tāpēc daži automašīnu ražotāji strādā ar automašīnām, kuras darbina ar ūdeņradi.
vai šī ir šķidrā ūdeņraža forma?
Nē - ūdeņradis šajā eksperimentā būs gāzveida
Kā es varu sašķidrināt ūdeņradi? Atbilde
Brīdinājumi
- Esiet piesardzīgs ar tīru ūdeņradi. Sajaucot ar gaisu, tas ir ļoti sprādzienbīstams.
- Pārliecinieties, ka no iekārtas, kurā jūs savācat ūdeņradi, ir noņemts viss pārējais gaiss.


