Saturs
Kaut arī visi viena elementa atomi satur vienādu protonu skaitu, neitronu skaits var mainīties. Zinot, cik daudz neitronu ir konkrētam atomam, var palīdzēt noteikt, vai daļiņa šajā elementā ir regulāra vai izotops, kurā būs vairāk vai mazāk neitronu. Neitronu skaita noteikšana atomā ir diezgan vienkārša un neprasa eksperimentus. Lai aprēķinātu neitronu skaitu regulārā atomā vai izotopā, izpildiet šīs instrukcijas ar periodisko tabulu rokā.
Pakāpieni
1. metode no 2: neitrālu skaita atrašana kopējā atomā
Periodiskajā tabulā atrodiet elementu. Šajā piemērā apskatīsim OS (Os), kas atrodas sestajā rindā, no augšas uz leju.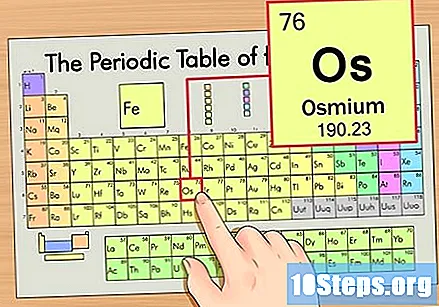
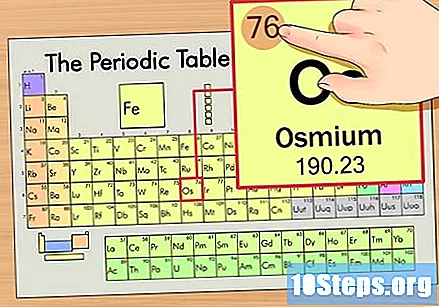
Atrodiet elementa atomu numuru. Tas parasti ir visredzamākais skaitlis konkrētam elementam un parasti ir virs tā simbola (tabulā, kuru mēs izmantojam, faktiski cita nosaukuma nav.) Atomu skaitlis ir protonu skaits viena elementa vienā atomā. Os skaits ir 76, kas nozīmē, ka osmija atomā ir 76 protoni.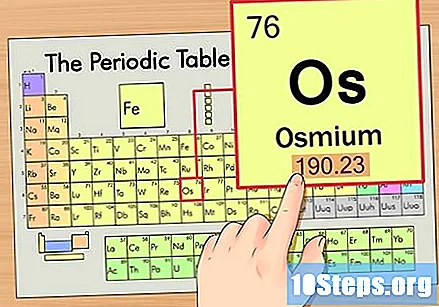
Atrodiet elementa atomu svaru. Šis skaitlis parasti ir atrodams zem atoma simbola. Ņemiet vērā, ka šī piemēra tabula ir balstīta tikai uz atomu skaitli un tajā nav uzskaitīts atoma svars. Tas ne vienmēr notiks. Osmija atoma svars ir 190,23.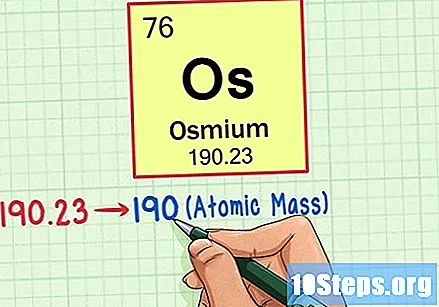
Noapaļo atoma svaru līdz tuvākajam veselajam skaitlim, lai atomu atomu iegūtu. Mūsu piemērā 190,23 tiktu noapaļots līdz 190, iegūstot Osmija atomu masu 190.- Atomu masa ir elementa izotopu vidējā vērtība. Tāpēc tas parasti nav vesels skaitlis.
No atoma masas atņem atomu skaitu. Tā kā lielākais atoma masas daudzums ir atrodams tā protonos un neitrālos, atņemot protonu skaitu (tas ir, atoma numuru) no atoma masas, jūs iegūsit skaitli aprēķināts neitronu atomā. Skaitlis aiz komata parasti apzīmē ļoti mazu elektronu masu atomā. Mūsu piemērā tas ir: 190 (atomu masa) - 76 (protonu skaits) = 114 (neitronu skaits).
Atcerieties formulu. Lai atrastu neitronu skaitu nākotnē, izmantojiet tikai šo formulu: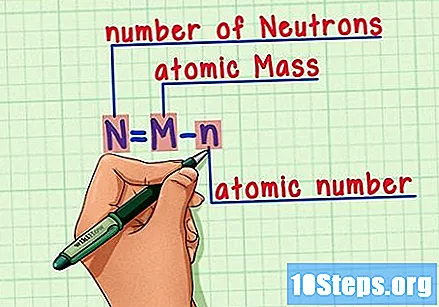
- N = M - n.
- N = Neitroni.
- M = Matomu cepetis.
- n = natomu apakšstilba.
- N = M - n.
2. metode no 2: neitronu skaita noteikšana izotopā
Periodiskajā tabulā atrodiet elementu. Piemēram, izmantosim oglekļa-14 izotopu. Tā kā oglekļa-14 neizotopā ir vienkārši ogleklis (C), atrodiet šo elementu periodiskajā tabulā (otrajā rindā).
Atrodiet elementa atomu numuru. Tas parasti ir visredzamākais skaitlis konkrētam elementam un parasti ir virs tā simbola (tabulā, kuru mēs izmantojam, faktiski cita nosaukuma nav.) Atomu skaitlis ir protonu skaits viena elementa vienā atomā. C ir skaitlis 6, kas nozīmē, ka oglekļa atomā ir 6 protoni.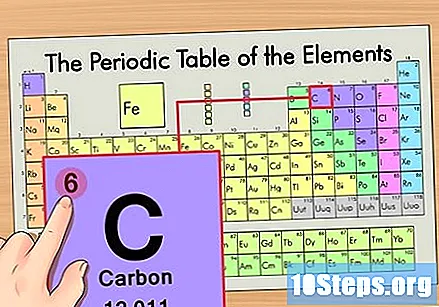
Atrodiet atomu masu. Tas ir neticami viegli ar izotopiem, jo tie ir nosaukti pēc to atomu masas. Oglekļa-14 atomu masa ir 14. Kad esat atradis izotopu atomu masu, neitronu skaita noteikšanas process ir tāds pats kā parastajiem atomiem.
No atoma masas atņem atomu skaitu. Tā kā lielākais atoma masas daudzums ir atrodams tā protonos un neitrālos, atņemot protonu skaitu (tas ir, atoma numuru) no atoma masas, jūs iegūsit skaitli aprēķināts neitronu atomā. Skaitlis aiz komata parasti apzīmē ļoti mazu elektronu masu atomā. Mūsu piemērā tas ir: 14 (atomu masa) - 6 (protonu skaits) = 8 (neitronu skaits).
Atcerieties formulu. Lai atrastu neitronu skaitu nākotnē, izmantojiet tikai šo formulu: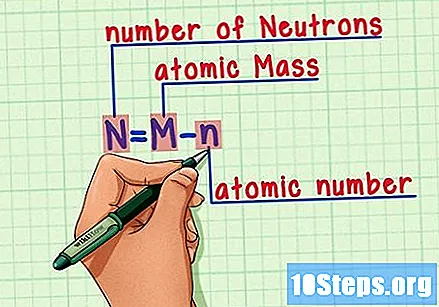
- N = M - n.
- N = Neitroni.
- M = Matomu cepetis.
- n = natomu apakšstilba.
- N = M - n.
Padomi
- Osmijs, ciets metāls istabas temperatūrā, iegūst savu vārdu no grieķu vārda “smarža”, “osme”.
- Protoni un neitroni veido gandrīz visu elementu svaru, savukārt elektroni un citas dažādas daļiņas veido nenozīmīgu masu (tuvojas nulles masai). Tā kā protonam ir aptuveni tāds pats svars kā neitrālam, un atomu skaits apzīmē protonu skaitu, mēs varam vienkārši atņemt protonu skaitu no kopējās masas.
- Ja neesat pārliecināts, kurš skaitlis ir periodiskajā tabulā, atcerieties, ka tas parasti tiek veidots ap atomu skaitli (tas ir, protonu skaitu), kurš sākas ar 1 (ūdeņradis) un palielinās par vienu vienību uz no kreisās uz labo, beidzoties ar 118 (Ununóctio). Tas notiek tāpēc, ka protonu skaits atomā nosaka, kas tas ir, un tas atvieglo elementārā raksturlieluma organizēšanu (piemēram, atoms ar 2 protoniem vienmēr būs hēlijs, tāpat kā cits atoms ar 79 protoniem vienmēr būs zelts).