Saturs
Citas sadaļasĶīmijā valences elektroni ir elektroni, kas atrodas elementa visattālākajā elektronu apvalkā. Zināt, kā noteikt valences elektronu skaitu konkrētā atomā, ir svarīga ķīmiķu prasme, jo šī informācija nosaka ķīmisko saišu veidus, kādus tā var veidot, un līdz ar to arī elementa reaktivitāti. Par laimi, viss, kas jums nepieciešams, lai atrastu elementa valences elektronus, ir standarta periodiskā elementu tabula.
Soļi
1. daļa no 2: Valences elektronu atrašana ar periodisko tabulu
Metāli bez pārejas
Atrodi periodiskā elementu tabula. Šī ir krāsu kodēta tabula, kas sastāv no daudziem dažādiem kvadrātiem un kurā ir uzskaitīti visi cilvēcei zināmie ķīmiskie elementi. Periodiskā tabula atklāj daudz informācijas par elementiem - daļu no šīs informācijas mēs izmantosim, lai noteiktu valences elektronu skaitu atomā, kuru mēs pētām. Parasti tos var atrast ķīmijas mācību grāmatu vāka iekšpusē. Šeit tiešsaistē ir pieejams arī lielisks interaktīvs galds.

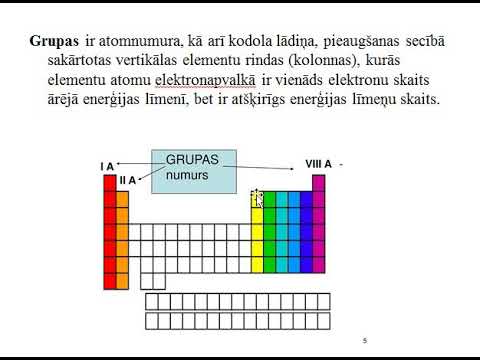
Marķējiet katru kolonnu periodiskās tabulas elementos no 1 līdz 18. Parasti periodiskajā tabulā visiem vienas vertikālās kolonnas elementiem būs vienāds valences elektronu skaits. Ja jūsu periodiskajā tabulā katra kolonna jau nav numurēta, piešķiriet katrai skaitli, sākot ar 1 - kreisajam galam un 18 - galējam labajam galam. Zinātniski šīs kolonnas sauc par elementu "grupas".- Piemēram, ja mēs strādājam ar periodisku tabulu, kurā grupas nav numurētas, mēs rakstītu 1 virs ūdeņraža (H), 2 virs berilija (Be) un tā tālāk, līdz rakstām 18 virs hēlija (Viņš) .

Atrodiet savu elementu uz galda. Tagad uz galda atrodiet elementu, kuram vēlaties atrast valences elektronus. To var izdarīt ar tā ķīmisko simbolu (burti katrā lodziņā), tā atomu numuru (skaitlis katras lodziņa augšējā kreisajā stūrī) vai jebkuru citu informāciju, kas jums pieejama uz galda.- Piemēram, atradīsim ļoti izplatīta elementa valences elektronus: ogleklis (C). Šim elementam ir atomu skaitlis 6. Tas atrodas 14. grupas augšdaļā. Nākamajā solī mēs atradīsim tā valences elektronus.
- Šajā apakšnodaļā mēs ignorēsim pārejas perioda metālus, kas ir elementi taisnstūra formas blokā, ko izveidoja 3. līdz 12. grupa. Šie elementi nedaudz atšķiras no pārējiem, tāpēc uzvarēja šīs apakšsadaļas darbības " t pie viņiem strādāt. Kā rīkoties ar tiem, skatiet tālāk esošajā apakšsadaļā.

Izmantojiet grupas numurus, lai noteiktu valences elektronu skaitu. Nepārejas metāla grupas numuru var izmantot, lai atrastu valences elektronu skaitu šī elementa atomā. The grupas numura vietas ir valences elektronu skaits šo elementu atomā. Citiem vārdiem sakot:- 1. grupa: 1 valences elektrons
- 2. grupa: 2 valences elektroni
- 13. grupa: 3 valences elektroni
- 14. grupa: 4 valences elektroni
- 15. grupa: 5 valences elektroni
- 16. grupa: 6 valences elektroni
- 17. grupa: 7 valences elektroni
- 18. grupa: 8 valences elektroni (izņemot hēliju, kuram ir 2)
- Mūsu piemērā, tā kā ogleklis ir 14. grupā, mēs varam teikt, ka vienam oglekļa atomam ir četri valences elektroni.
Pārejas metāli
Atrodiet elementu no 3. līdz 12. grupai. Kā minēts iepriekš, 3. līdz 12. grupas elementus sauc par "pārejas metāliem" un tie izturas savādāk nekā pārējie elementi, kad runa ir par valences elektroniem. Šajā sadaļā mēs paskaidrosim, kā zināmā mērā bieži nav iespējams piešķirt šiem atomiem valences elektronus.
- Piemēram, izvēlēsimies Tantalu (Ta), 73. elementu. Nākamajās dažās darbībās mēs atradīsim tā valences elektronus (vai vismaz mēģiniet līdz.)
- Ņemiet vērā, ka pārejas metāli ietver lantanīda un aktinīda sērijas (sauktas arī par "retzemju metāliem") - divas elementu rindas, kas parasti atrodas zem pārējās tabulas un sākas ar lantānu un aktīniju. Šie elementi visi pieder 3. grupa periodiskās tabulas.
Saprotiet, ka pārejas metāliem nav "tradicionālu" valences elektronu. Lai saprastu, kāpēc pārejas metāli patiesībā "nedarbojas" tāpat kā pārējā periodiskā tabula, ir nepieciešams nedaudz paskaidrot, kā elektroni izturas atomos. Skatiet zemāk, lai ātri apskatītu, vai izlaidiet šo soli, lai iegūtu pareizās atbildes.
- Pievienojot elektronus atomam, tie tiek sakārtoti dažādās "orbitālēs" - būtībā dažādās zonās ap kodolu, kurā elektroni sapulcējas. Parasti valences elektroni ir ārējā apvalka elektroni - citiem vārdiem sakot, pēdējie pievienotie elektroni .
- Iemeslu dēļ, kas ir nedaudz pārāk sarežģīti, lai to šeit izskaidrotu, kad elektronus pievieno visattālākajiem d pārejas metāla apvalks (vairāk par to zemāk), pirmie elektroni, kas nonāk apvalkā, mēdz rīkoties kā parastie valences elektroni, bet pēc tam tie nedarbojas, un citu orbītas slāņu elektroni dažkārt darbojas kā valences elektroni. Tas nozīmē, ka atomam var būt vairāki valences elektronu skaitļi atkarībā no tā, kā ar to tiek manipulēts.
Nosakiet valences elektronu skaitu, pamatojoties uz grupas numuru. Atkal pētāmā elementa grupas numurs var pateikt tā valences elektronus. Tomēr pārejas metāliem nav parauga, kuru varētu sekot - grupas numurs parasti atbilst iespējamo valences elektronu skaita diapazonam. Šie ir:
- 3. grupa: 3 valences elektroni
- 4. grupa: 2 līdz 4 valences elektroni
- 5. grupa: 2 līdz 5 valences elektroni
- 6. grupa: 2 līdz 6 valences elektroni
- 7. grupa: 2 līdz 7 valences elektroni
- 8. grupa: 2 vai 3 valences elektroni
- 9. grupa: 2 vai 3 valences elektroni
- 10. grupa: 2 vai 3 valences elektroni
- 11. grupa: 1 vai 2 valences elektroni
- 12. grupa: 2 valences elektroni
- Mūsu piemērā, tā kā tantals ir 5. grupā, mēs varam teikt, ka tam ir starp divi un pieci valences elektroni, atkarībā no situācijas.
2. daļa no 2: Valences elektronu atrašana ar elektronu konfigurāciju
Uzziniet, kā nolasīt elektronu konfigurāciju. Vēl viens veids, kā atrast elementa valences elektronus, ir tāds, ko sauc par elektronu konfigurāciju. Sākumā tie var izskatīties sarežģīti, taču tie ir tikai veids, kā atveidot elektronu orbitāles atomā ar burtiem un cipariem, un tie ir viegli, kad zināt, ko skatāties.
- Apskatīsim elementa nātrija (Na) konfigurācijas piemēru:
- 1s2s2p3s
- Ievērojiet, ka šī elektronu konfigurācija ir tikai atkārtota virkne, kas darbojas šādi:
- (numurs) (burts) (numurs) (burts) ...
- ...un tā tālāk. The (numurs) (burts) gabals ir elektronu orbitāles nosaukums, un ir elektronu skaits šajā orbītā - tas ir viss!
- Tātad, piemēram, mēs teiktu, ka nātrijam ir 2 elektroni 1s orbītā plus 2s orbītā 2 elektroni plus 6 elektroni 2p orbitālē plus 1 elektrons 3s orbītā. Tas ir kopā 11 elektroni - nātrijs ir elementa numurs 11, tāpēc tam ir jēga.
- Paturiet prātā, ka katrai apakškorpusai ir noteikta elektronu ietilpība. Viņu elektronu ietilpība ir šāda:
- s: 2 elektronu ietilpība
- p: 6 elektronu ietilpība
- d: 10 elektronu ietilpība
- f: 14 elektronu ietilpība
- Apskatīsim elementa nātrija (Na) konfigurācijas piemēru:
Atrodiet pārbaudāmā elementa elektronu konfigurāciju. Tiklīdz jūs zināt elementa elektronu konfigurāciju, tā valences elektronu skaita atrašana ir pavisam vienkārša (protams, izņemot pārejas metālus.) Ja konfigurācija jums tiek piešķirta no sākuma, varat pāriet uz nākamo soli. Ja jums tas jāatrod pašam, skatiet zemāk:
- Pārbaudiet pilnīgu elektronu konfigurāciju oganesson (Og) elementam 118., kas ir pēdējais elements periodiskajā tabulā. Tajā ir visvairāk elektronu no jebkura elementa, tāpēc tā elektronu konfigurācija parāda visas iespējas, ar kurām jūs varētu saskarties citos elementos:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Tagad, kad jums tas ir, viss, kas jums jādara, lai atrastu citu atomu elektronu konfigurāciju, ir vienkārši aizpildīt šo modeli no sākuma, līdz beidzas elektroni. Tas ir vieglāk, nekā izklausās. Piemēram, ja mēs vēlamies izveidot orbītas diagrammu hloram (Cl), 17. elementam, kurā ir 17 elektroni, mēs to darītu šādi:
- 1s2s2p3s3p
- Ievērojiet, ka elektronu skaits ir līdz 17: 2 + 2 + 6 + 2 + 5 = 17. Jums ir jāmaina skaitlis tikai pēdējā orbītā - pārējais ir tāds pats, jo orbitāles pirms pēdējās ir pilnīgi pilnas .
- Plašāku informāciju par elektronu konfigurācijām skatiet arī šajā rakstā.
- Pārbaudiet pilnīgu elektronu konfigurāciju oganesson (Og) elementam 118., kas ir pēdējais elements periodiskajā tabulā. Tajā ir visvairāk elektronu no jebkura elementa, tāpēc tā elektronu konfigurācija parāda visas iespējas, ar kurām jūs varētu saskarties citos elementos:
Piešķiriet elektronus orbītas čaumalām ar Octet Rule. Pievienojot elektronus atomam, tie ietilpst dažādās orbitālēs saskaņā ar iepriekš norādīto secību - pirmie divi nonāk 1s orbītā, divi pēc tam - 2s orbītā, seši pēc tam - 2p orbītā un tā tālāk. Kad mums ir darīšana ar atomiem ārpus pārejas metāliem, mēs sakām, ka šīs orbitāles veido "orbītas čaumalas" ap kodolu, un katra nākamā apvalka atrodas tālāk nekā iepriekš. Bez pašas pirmās čaulas, kurā var ievietot tikai divus elektronus, katrā apvalkā var būt astoņi elektroni (izņemot, atkal strādājot ar pārejas metāliem.) To sauc par Okteta likums.
- Piemēram, pieņemsim, ka mēs skatāmies uz elementu Borons (B). Tā kā tā atomu skaitlis ir pieci, mēs zinām, ka tam ir pieci elektroni, un tā elektronu konfigurācija izskatās šādi: 1s2s2p. Tā kā pirmajā orbītas apvalkā ir tikai divi elektroni, mēs zinām, ka Boronam ir divi apvalki: viens ar diviem 1s elektroniem un otrs ar trim elektroniem no 2s un 2p orbitālēm.
- Kā vēl vienu piemēru tādam elementam kā hlors (1s2s2p3s3p) būs trīs orbītas apvalki: viens ar diviem 1s elektroniem, viens ar diviem 2s elektroniem un sešiem 2p elektroniem un viens ar diviem 3s elektroniem un pieciem 3p elektroniem.
Atrodiet elektronu skaitu visattālākajā apvalkā. Tagad, kad jūs zināt sava elementa elektronu apvalkus, valences elektronu atrašana ir vienkārša: vienkārši izmantojiet elektronu skaitu vistālākajā apvalkā. Ja ārējais apvalks ir pilns (citiem vārdiem sakot, ja tam ir astoņi elektroni vai, pirmajam apvalkam, divi), elements ir inerts un ar citiem elementiem viegli nereaģēs. Atkal, tomēr lietas ne visai ievēro šos pārejas metālu noteikumus.
- Piemēram, ja mēs strādājam ar Boronu, tā kā otrajā apvalkā ir trīs elektroni, mēs varam teikt, ka Boronam ir trīs valences elektroni.
Izmantojiet tabulas rindas kā orbitālās čaulas saīsnes. Periodiskās tabulas horizontālās rindas sauc par elementu "periodi". Sākot no tabulas augšdaļas, katrs periods atbilst punktu skaitam elektronu čaulas perioda atomi piemīt. To var izmantot kā saīsni, lai noteiktu, cik daudz valences elektronu ir elementam - skaitot elektronus, vienkārši sāciet no perioda kreisās puses. Vēlreiz jūs vēlaties ignorēt pārejas metālus, izmantojot šo metodi, kas ietver 3.-12.
- Piemēram, mēs zinām, ka selēna elementam ir četras orbitālās čaulas, jo tas atrodas ceturtajā periodā. Tā kā tas ir sestais elements no kreisās puses ceturtajā periodā (ignorējot pārejas metālus), mēs zinām, ka ārējā ceturtajā apvalkā ir seši elektroni, un tādējādi selēns ir seši valences elektroni.
Kopienas jautājumi un atbildes
Kā mēs aprēķinām valences elektronu?
Valences elektronus var atrast, nosakot elementu elektroniskās konfigurācijas. Pēc tam elektronu skaits visattālākajā apvalkā dod kopējo valences elektronu skaitu šajā elementā.
Ja atomā ir 33 elektroni, cik daudz valences elektronu ir?
Ja atoms nav jons, tad mēs varam teikt, ka atomam ir 33 protoni. Tas nozīmē, ka tas ir 33. elements, kas ir arsēns. Tad mēs zinām, ka tas nav pārejas metāls, tāpēc mēs meklējam un atrodam, ka tā grupas numura vienības cipars ir 5, kas nozīmē, ka tajā ir 5 valences elektroni.
Kā es varu noteikt hēlija atomu skaitu?
Protonu skaits ir vienāds ar atomu skaitli.
Kāpēc elektroni iegūst negatīvu lādiņu, nevis pozitīvu lādiņu?
Atomi iegūst vai zaudē elektronus, negatīvus lādiņus, jo protoniem ir pozitīvs lādiņš un tos kodolā notur spēcīgais kodolspēks. Šis ir viens no četriem atšķirīgajiem Visuma spēkiem: gravitācija, elektromagnētisms, vājais spēks un spēcīgais kodolspēks. Tam jābūt spēcīgam, jo protoni viens otru atgrūž, tomēr tie patiešām atrodas tuvu kodolā (kopā ar neitroniem, kurus tur arī spēcīgais spēks.) Ideja ir tāda, ka spēcīgais spēks ir ārkārtīgi spēcīgs, bet tikai ļoti mazos attālumos. Padomājiet par sīkiem, ļoti spēcīgiem āķiem. Lai piesaistītu protonus un neitronus, jums ir nepieciešami tādi spēki kā milzīgs zvaigznes, supernovas vai kodolsprādziena smagums.
Kāds ir cēlgāzu valance elektrons?
Cēlām gāzēm ir astoņi valences elektroni - visstabilākais elementa stāvoklis.
Kāpēc slāpeklim ir 6 valance elektroni, bet tas ir 15. grupā?
Slāpeklim ir tikai pieci valences elektroni, jo tas ir 5. grupā, lai gan tas faktiski ir 15. grupā, jūs ignorēsiet pārejas metālus, jo šīm grupām ir atšķirīgs veids, kā noteikt to valences elektronus. Tāpēc: 13. grupa nozīmē 3. grupu utt.
Atomam ir 7 protoni, 8 neironi un 7 elektroni. Cik daudz elektronu ir tā valences apvalkā?
Elements, kas satur 7 protonus, ir slāpeklis. Slāpeklis atrodas elementu kolonnā, kura valences apvalkā ir 5 elektroni. Neitronu skaitam nav nozīmes, lai noteiktu valences elektronu skaitu konkrētā elementā.
Kur uz periodiskās tabulas atrodas atomi ar septiņiem ārējā apvalka elektroniem?
Skatieties otrajā līdz pēdējā slejā labajā pusē, blakus inertajām gāzēm.
Kas ir valences elektrons?
Valences elektrons ir elektrons, kas atrodas uz atoma attālākās daļas un var būt kopīgs vai paņemts reakcijā.
Kāpēc periodiskās tabulas elementiem ir atšķirīgs valences elektronu skaits?
Viņiem ir dažādas ķīmiskās struktūras. Valences elektroni ir tie, kas rada ķīmiskas reakcijas.
Padomi
- Ievērojiet, ka elektronu konfigurācijas var rakstīt sava veida stenogrammā, izmantojot cēlgāzes (18. grupas elementus), lai konfigurācijas sākumā iestātos orbitālēs. Piemēram, nātrija elektronu konfigurāciju var uzrakstīt 3s1 - būtībā tas ir tāds pats kā neons, bet ar vēl vienu elektronu 3s orbitālē.
- Pārejas metāliem var būt valences apakškorpusi, kas nav pilnībā aizpildīti. Precīza valence elektronu skaita noteikšana pārejas metālos ietver kvantu teorijas principus, kas ir ārpus šī raksta darbības jomas.
- Ņem vērā, ka periodiskās tabulas dažādās valstīs atšķiras. Lūdzu, pārbaudiet, vai izmantojat pareizo, atjaunināto, lai izvairītos no neskaidrībām.
- Pārliecinieties, lai uzzinātu, kad pievienot vai atņemt pēdējo orbītu valences elektronu atrašanai.
Jums nepieciešamās lietas
- Periodiskā elementu tabula
- Zīmulis
- Papīrs
Katru dienu vietnē wikiHow mēs cītīgi strādājam, lai sniegtu jums piekļuvi instrukcijām un informācijai, kas palīdzēs jums dzīvot labāk, neatkarīgi no tā, vai tas jūs uzturēs drošāk, veselīgāk vai uzlabos pašsajūtu. Pašreizējās sabiedrības veselības un ekonomikas krīzes apstākļos, kad pasaule krasi mainās un mēs visi mācāmies un pielāgojamies ikdienas dzīves izmaiņām, cilvēkiem wikiHow ir vajadzīgs vairāk nekā jebkad agrāk. Jūsu atbalsts palīdz wikiHow izveidot padziļinātāk ilustrētus rakstus un videoklipus un dalīties mūsu uzticamā zīmola mācību saturā ar miljoniem cilvēku visā pasaulē. Lūdzu, apsveriet iespēju šodien dot ieguldījumu wikiHow.